2022江西高考化学冲刺卷试题
相对原子质量: H-1C-12N-14 O-16 Na-23 Cl-35.5 S-32Cu-64
一、选择题(共15小题,每题只有一个正确答案,每题3分共45分)
1.下列说法正确的是( )
A.用反渗透膜从海水中分离出淡水,该过程未发生化学变化
B.酿酒过程中葡萄糖在酒化酶的作用下发生水解反应生成乙醇
C.纤维素、蛋白质、纤维素乙酸酯属于天然高分子材料
D.石油的分馏、煤的干馏都属于物理变化
2.下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 水玻璃 | 水煤气 | 硫酸 | 氨水 | 干冰 |
| B | 冰醋酸 | 铝热剂 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 纯碱 | 天然气 | 苛性钾 | 氢硫酸 | 碳酸钙 |
| D | 玻璃 | 盐酸 | 碳酸氢钠 | 次氯酸 | 氯气 |
3.下列各项表达中正确的是( )
A.N2H4的结构式
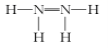
B.已知SCN-中每个原子都达到8电子结构,则其电子式为

C.比例模型

可以表示二氧化碳分子,也可以表示二氧化硫分子
D.全降解塑料
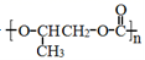
可由环氧丙烷(
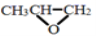
)和CO2缩聚制得
4.下列水处理方法涉及氧化还原反应的是( )
A.用明矾处理水中的悬浮物
B.用Na2S处理水中的Cu2+、Hg2+等重金属离子
C.用FeSO4处理含Cr2O72-的酸性废水,再调节pH除去Cr3+
D.用NaOH处理含高浓度NH4+的废水并回收利用氨
5.下列离子方程式书写正确的是()
A.氢氧化钙溶液与碳酸氢镁溶液反应:
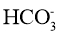
+Ca2++OH-=CaCO3↓+H2O
B.向酸性KMnO4溶液中加NaHSO3溶液,溶液紫色褪去2
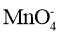
+5
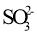
+6H+=2Mn2++5
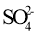
+3H2O
C.[Ag(NH3)2]OH与足量盐酸反应生成AgCl:[Ag(NH3)2]++OH-+3H++C1-=AgCl↓+2
+H2O
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
6.设NA为阿伏加德罗常数的值,下列说法正确的是()
A.常温常压下,48gO3,所含的氧原子数为3NA
B.等物质的量的P4与CO2所含共价键数目之比为3:1
C.1mol乙酸与足量的C2H518OH充分发生酯化反应可生成CH3CO18OC2H5分子NA个
D.浓度均为1mol/L的醋酸和醋酸钠溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA
7.化学制备萘(
)的合成过程如图
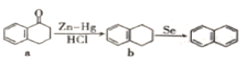
,下列说法正确的是()
A.a的分子式是C10H12OB.萘的二氯代物有10种
C.b的所有碳原子可能处于同一平面D.a→b的反应类型为加成反应
8.甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如下。下列说法中不正确的是
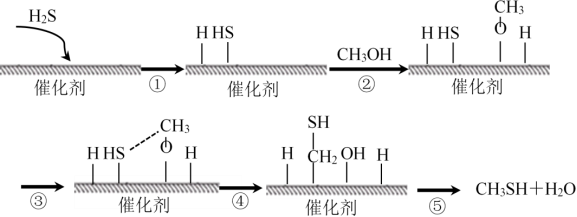
A.过程①吸收能量
B.过程④中,形成了O—H键和C—S键
C.该催化剂可降低反应活化能从而有效提高反应物的平衡转化率
D.硫化氢与甲醇合成甲硫醇的反应类型为取代反应
9.下列试剂的保存方法中错误的是()
A.少量的钠保存在煤油中
B.新制的氯水保存在棕色玻璃瓶中
C.NaOH溶液保存在带橡皮塞的玻璃瓶中
D.氢氟酸保存在玻璃瓶中
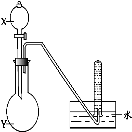
10、用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
| A | B | C | D |
| |
| X中试剂 | 浓硝酸 | 浓硫酸 | 双氧水 | 浓氨水 | |
| Y中试剂 | Cu | C2H5OH | MnO2 | NaOH | |
| 气体 | NO2 | C2H4 | O2 | NH3 |
11、元素铬(Cr)的几种化合物存在下列转化关系:
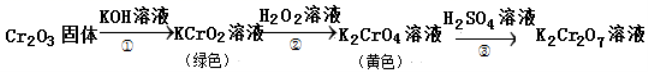
下列判断不正确

是
A.反应①表明Cr2O3有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应③中溶液颜色变化是由化学平衡移动引起的
D.反应①②③中铬元素的化合价均发生了变化
12.下列事实能说明元素的金属性或非金属性相对强弱的是
| 序号 | 事实 | 推论 |
| A | t℃时,Br2+H22HBrK = 5.6×107 I2+H22HIK = 43 | 非金属性:Br > I | B | Mg、Al分别与NaOH溶液反应,Al可以换H2 | 金属性:A1> Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
| D | Na与A1Cl3溶液反应有白色沉淀生成 | 金属性:Na > Al |
13.X、Y、Z、W为短周期主族元素且原子序数依次增大,X原子在元素周期表中半径最小,有机物中都含有Y元素,Y、Z、W同周期,由四种元素形成的一种化合物甲的结构如图所示。下列说法错误的是
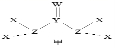
A.最高化合价: Z>Y> X
B.(YZ)2和YW2均为直线型分子
C.化合物甲是一种优质化肥
D.X分别与Y、Z、W形成的分子,沸点最高的是X2W
14.某种利用垃圾渗透液实现发电装置示意图如下,当该装置工作时,下列说法不正确的是
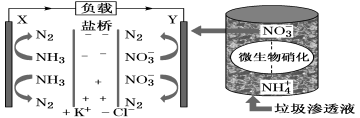
A.盐桥中K+向Y极移动
B.电路中流过7.5 mol电子时,共产生标准状况下N2的体积为16.8L
C.电子流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH—,周围pH增大
15.某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收
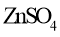
溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:

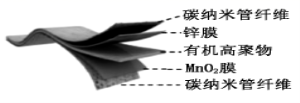
下列说法中,正确的是( )
A.放电时,
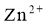
移向Zn膜
B.充电时,含有Zn膜的碳纳米管纤维一端连接有机高聚物电源正极
C.放电时,电子由锌膜表面经有机高聚物至
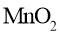
膜表面
D.放电时,电池的正极反应为:
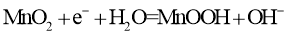
二、填空题(55分)
16.(9分)钴是一种中等活泼金属,化合价为+2价和+3价。某校同学利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdC12溶液能被CO还原为Pd。
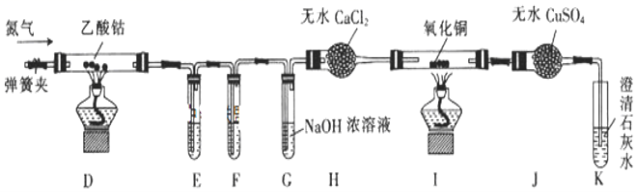
(1)装置E、F是用于检验CO和CO2的,其中盛放PdC12溶液的是装置______(填“E”或“F”)。
(2)装置G的作用是______;E、F、G中的试剂均足量且充分反应,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______。
(3)实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______。
(4)若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______。
17、(12分)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)CH3OH(g) △H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)CO(g)+H2O(g) △H3
回答下列问题:
(1)反应①的化学平衡常数K的表达式为__________;
(2)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | CO | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=______kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=________kJ·mol-1。
(3)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
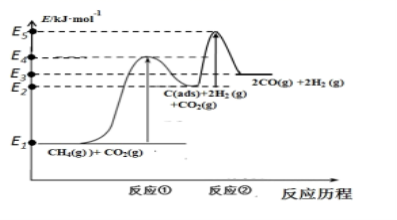
CH4与CO2制备合成气的热化学方程式为__________________。
(4) 利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
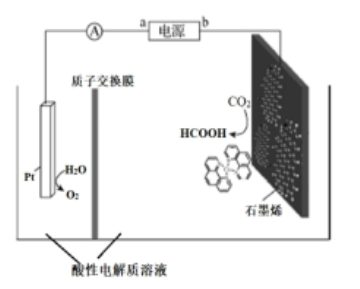
①电池工作过程中,图中Pt电极附近溶液的pH_______(填“变大”或“变小”),阴极的电极反应式为________________。
②每转移2mol电子,阴极室溶液质量增加______g。
18.(11分)亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:
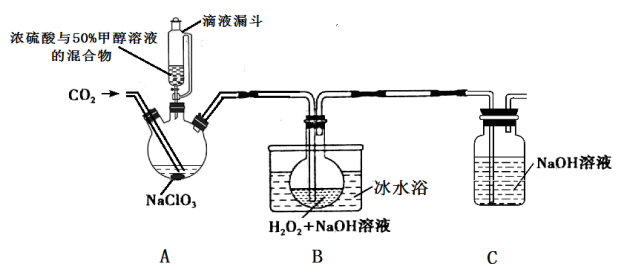
已知:
(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是______。
(2)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为___________。
(3)装置B中生成NaClO2的化学方程式是____。
(4)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a. 控制在38~60℃之间蒸发浓缩;b._____;c.用38~60℃的热水洗涤;d.在低于60oC的真空中蒸发,干燥。
(5)装置C的作用为___________。
(6)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水与过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________。
19、(12分)某矿样中含有大量的 CuS 及少量其他不含铜不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O 晶体,流程如下:
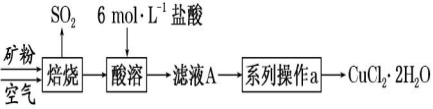
(1)①若在实验室中完成系列操作 a。则下列实验操作中,不需要的是____________(填字母)。
②CuCl2 溶液中存在平衡:Cu(H2O)42+(蓝色)+4Cl-CuCl42-(黄色)+4H2O。欲用实验证明滤液 A(绿色)中存在上述平衡,除滤液 A 外,下列试剂中还需要的是_____(填字 母)。
a.FeCl3 固体b.CuCl2 固体c.蒸馏水
(2)某化学小组欲在实验室中研究 CuS 焙烧的反应过程,查阅资料得知在空气中焙烧 CuS 时,固体 质量变化曲线及 SO2 生成曲线如图。
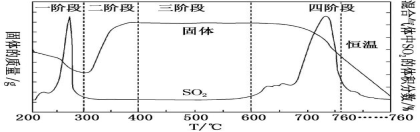
①CuS 矿样在焙烧过程中,有 Cu2S、CuO·CuSO4、CuSO4、CuO 生成,转化顺序为CuS
Cu2S
CuO·CuSO4
CuSO4
CuO第①步转化主要在200~300 ℃内进行,该步转化的话学方程式__________________。
②300~400 ℃内,固体质量明显增加的原因是_________________.
③实验证明第四阶段所得混合气体所需试剂为________、________。
④若原 CuS 矿样的质量为 10.0 g,实验过程中,保持在 760 ℃左右持续加热,待矿样充分反应后, 所得固体的质量为 8.0 g,则原矿样中 CuS 的质量分数为_____。
20.(11分) 从废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如图所示:
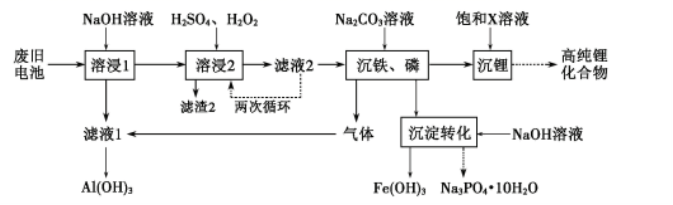
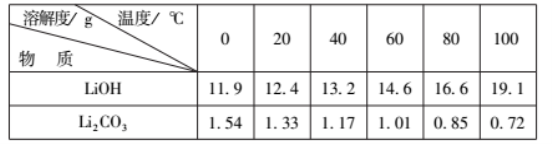
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为___________________________。
(2)完成“溶浸2”反应的离子方程式___________________________:

LiFePO4+

H2O2+

=

Li++

+

H2PO4-+

H2O
(3)“滤渣2”的主要成分是_______________。
(4)“滤液2”循环两次的目的是___________________________。
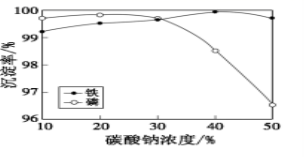
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为_______________________。实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是___________________________。
(6)为了充分沉淀,“沉锂”时所用的X和适宜温度是___(填标号)。
A.NaOH20-40℃B.NaOH80-100℃
C.Na2CO320-40℃D.Na2CO360-80℃
·1·